- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
L’oncologie constitue, avec la cardiologie, l’une des principales thématiques de recherche du laboratoire. Les projets précliniques portent sur le développement de candidats radiopharmaceutiques développés à partir de différentes classes de molécule, telles que les molécules de synthèse (RAFT-RGD), les sdAb ou nanobodies (projet Mésothéline) ou encore, plus récemment, le développement de sondes intelligentes activables in vivo (Healtrig).
L'une des approches thérapeutiques prometteuses dans la prise en charge du cancer est la radiothérapie interne vectorisée (RIV), qui consiste à cibler une protéine tumorale d'intérêt avec un ligand spécifique, marqué avec un atome émetteur de rayonnement beta – ou alpha. Ce ciblage spécifique permet de limiter l'irradiation aux sites de fixation du ligand. Ces traitements étant relativement lourds, on doit s'assurer au préalable que la cible est bien présente sur la tumeur. On réalise pour cela un test diagnostic (imagerie SPECT ou PET) avec le même ligand, mais marqué avec un atome émetteur de rayonnement gamma ou beta +. Ce même agent, utilisé soit pour le diagnostic, soit pour la thérapie est appelé agent théranostique.
Nos projets
Projet Mésothéline
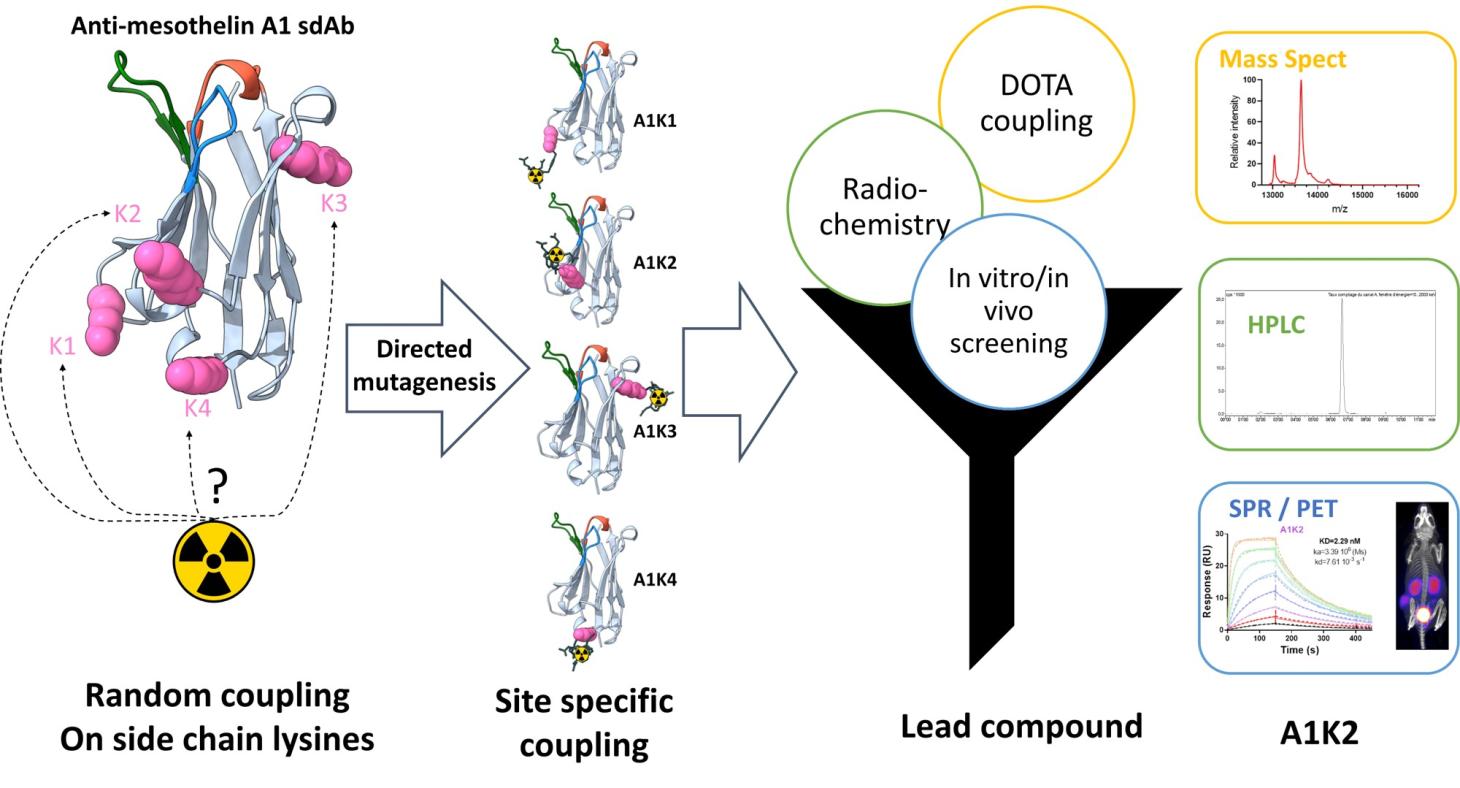
La mésothéline est une protéine dont l’expression dans les tissus sains est limitée aux cellules mésothéliales tapissant le péricarde, le péritoine et la plèvre. La fonction biologique de la mésothéline n'est pas connue et aucune anomalie détectable n'a été observée chez des souris déficientes en cette protéine.
Cependant, la mésothéline est surexprimée dans plusieurs tumeurs malignes humaines : 100 % des mésothéliomes épithéliaux, la majorité des adénocarcinomes du pancréas et de l'ovaire, plus de 50 % des adénocarcinomes du poumon, et 34 à 67 % des cancers du sein triple négatifs. Elle semble être impliquée dans l'agressivité de la tumeur car son expression est corrélée à un pronostic plus péjoratif. L'expression limitée de la mésothéline dans les tissus sains et sa surexpression dans plusieurs cancers agressifs en font un candidat attrayant pour le développement de nouvelles thérapies.
Par conséquent, des thérapies ciblées dirigées contre la mésothéline font actuellement l'objet d'études cliniques. Nous avons développé, en collaboration avec le CRCM (Centre de Recherche en Cancérologie de Marseille, CNRS UMR 7258, Inserm U1068), un nanobody marqué au Tc-99m (99mTc-A1) permettant de réaliser l’imagerie phénotypique des tumeurs exprimant la mésothéline (MSLN). Nous avons ensuite produit par ingénierie des protéines des dérivés de A1 afin d’en faire un agent théranostique permettant de réaliser de l’imagerie diagnostique (PET) mais également de la radiothérapie interne vectorisée.
Projet HealTrig
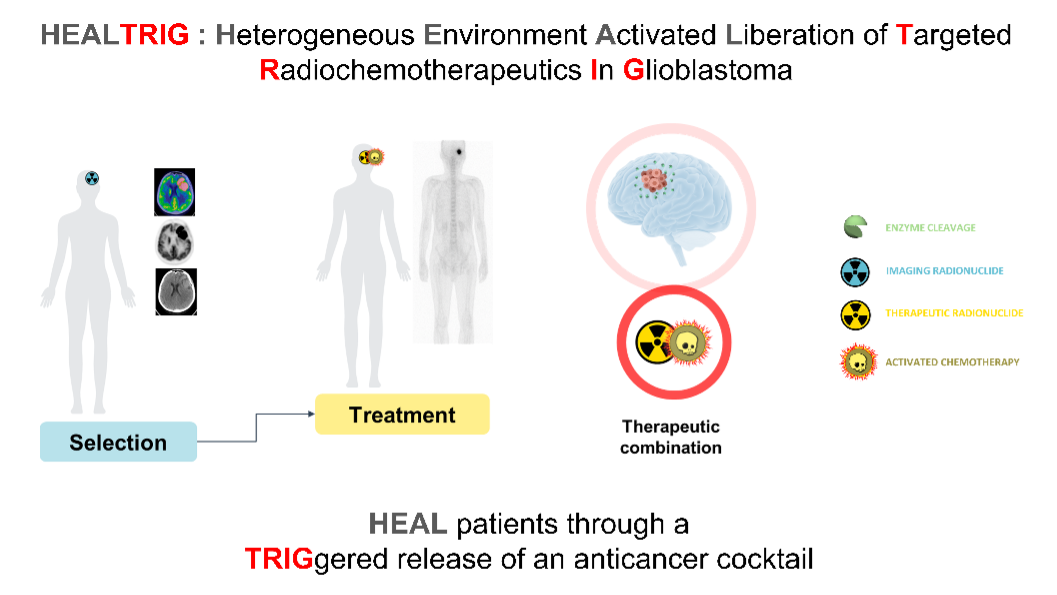
Le glioblastome est la tumeur maligne primaire cérébrale la plus fréquente et la plus agressive. Le pronostic sombre de cette pathologie souligne le besoin de développer de nouvelles approches thérapeutiques ciblées plus efficaces. Le microenvironnement tumoral est une cible très étudiée actuellement pour le développement de nouvelles stratégies thérapeutiques.
Le projet HEALTRIG (Heterogeneous Environment Activated Liberation of Targeted Radiochemotherapeutics In Glioblastoma) vise à développer une approche théranostique du glioblastome en utilisant des systèmes moléculaires programmés ciblant la β-glucuronidase, une enzyme extracellulaire spécifiquement présente dans le microenvironnement tumoral. Les molécules sont synthétisées en collaboration avec l’équipe OrgaSynth "Systèmes moléculaires programmés" de l’IC2MP de Poitiers (Institut de Chimie des Milieux et Matériaux de Poitiers), spécialisée dans la conception de systèmes moléculaires programmés pour la délivrance sélective de composés actifs et de composés sensibles à un stimulus, la volatolomique, la chémobiologie et la chimie in vivo. Sous l’effet de la β-glucuronidase, l'outil diagnostique compagnon libérera un radionucléide d'imagerie permettant la sélection des patients. La version thérapeutique libérera à la fois une chimiothérapie puissante activée sur site et un radionucléide thérapeutique. L’un des principaux avantages des molécules développées dans le cadre du projet HEALTRIG réside dans leur mode d’action innovant. Contrairement aux approches classiques qui reposent sur le ciblage d’un biomarqueur spécifique, ces systèmes moléculaires sont conçus pour déclencher une libération programmée et sélective directement dans l’environnement tumoral. Cette stratégie est particulièrement pertinente dans le contexte des cancers, où l’hétérogénéité des tissus malades peut limiter l’efficacité des traitements conventionnels. En permettant une diffusion ciblée au sein de différentes tumeurs sans dépendre d’un biomarqueur unique, ces molécules ouvrent la voie à une application plus large que celle du glioblastome, pour le traitement de multiples pathologies tumorales. Une fois cette preuve de concept validée, cette approche théranostique adaptée au patient permettra de diminuer les toxicités hors cible et d'éviter les effets indésirables, limitant la dose administrée habituellement, rencontrés lors du traitement des patients avec des chimiothérapies conventionnelles non ciblées.
D’autres approches se mettent en place autour de ce projet principal, qui s’intéresseront à l’utilisation des propriétés physiques des radionucléides thérapeutiques pour provoquer une libération contrôlée de molécules de chimiothérapie, ou encore pour potentialiser l’efficacité thérapeutique lorsqu’utilisées en combinaison.
Projet RAFT-RGD
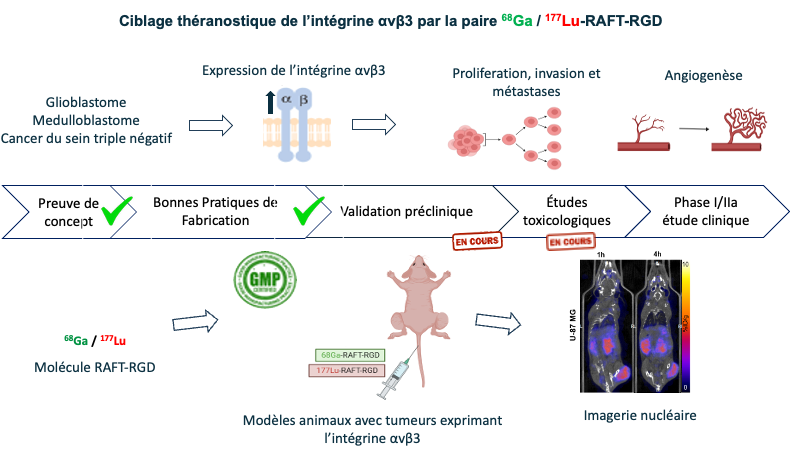
Les tumeurs solides comme le glioblastome (GBM), le médulloblastome (MB) et le cancer du sein triple négatif (CSTN) représentent des enjeux majeurs en oncologie. Leur agressivité, leur résistance aux traitements conventionnels et leur pronostic souvent défavorable appellent au développement de stratégies thérapeutiques innovantes. L'intégrine αvβ3, une molécule d'adhésion impliquée dans l'angiogenèse et la progression tumorale, est fortement exprimée dans ces cancers, ce qui en fait une cible stratégique.
Un agent théranostique prometteur ciblant l'intégrine αvβ3 est à l’étude au laboratoire et a été radiomarqué avec du Ga-68 pour le diagnostic et avec du Lu-177 pour la thérapie. Des études précliniques ont démontré le potentiel théranostique de cet agent. Une étude clinique sur des patients atteints soit de cancer du sein métastatique, soit de glioblastome sera réalisée au Centre Hospitalier Grenoble-Alpes (CHUGA) dans un essai de phase I / IIa. La première injection à l’homme est prévue en juin 2026.
CONTACTS
Responsables
Mesothéline :
Alexis Broisat
alexis.broisat inserm.fr (alexis[dot]broisat[at]inserm[dot]fr)
inserm.fr (alexis[dot]broisat[at]inserm[dot]fr)
Tél +33 (0)4 76 63 71 02
Healtrig :
Florian Raes
florian.raes inserm.fr (florian[dot]raes[at]inserm[dot]fr)
inserm.fr (florian[dot]raes[at]inserm[dot]fr)
RAFT-RGD :
Catherine Ghezzi
catherine.ghezzi univ-grenoble-alpes.fr (catherine[dot]ghezzi[at]univ-grenoble-alpes[dot]fr)
univ-grenoble-alpes.fr (catherine[dot]ghezzi[at]univ-grenoble-alpes[dot]fr)
Tél +33 (0)4 76 63 74 76
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn